Relawan Meninggal, Uji Vaksin AstraZeneca Kok Malah Lanjut?

Jakarta, CNBC Indonesia - Kabar mengejutkan datang dari salah satu pengembang vaksin Covid-19 paling diharapkan tahun ini, AstraZeneca. Uji klinis tahap akhir kandidat vaksin raksasa farmasi yang bermarkas di Cambridge, Inggris itu disebut memakan korban.
Seorang relawan studi asal Brazil yang kebetulan adalah seorang dokter berusia 28 tahun dikabarkan meninggal dunia. Menurut berbagai pemberitaan dokter relawan uji klinis tersebut banyak menangani pasien Covid-19.
Melansir BBC, Kamis (22/10/2020), relawan uji yang meninggal tidak mendapatkan vaksin Covid-19 buatan AstraZeneca. Evaluasi klinis kandidat vaksin AstraZeneca dibagi menjadi dua kelompok. Setengahnya mendapat suntikan kandidat vaksin AstraZeneca (AZD1112) dan sisanya mendapat suntikan vaksin meningitis yang sudah beredar dan digunakan.
Otoritas kesehatan Brazil tidak memberikan mendetail soal insiden ini dengan alasan karena mempertimbangkan protokol yang bersifat rahasia. Merespons pemberitaan ini, Universitas Oxford yang juga bertindak sebagai mitra AstraZeneca akhirnya angkat bicara.
Pihak Universitas Oxford mengatakan sudah melakukan tinjauan dengan sangat hati-hati dan tak ada yang menyalahi aturan serta tidak ada yang perlu dikhawatirkan. Hal tersebut juga diungkapkan oleh pihak reviewer independen.
Kasus kematian atau dampak negatif dalam uji klinis kandidat vaksin/obat suatu penyakit bukanlah hal yang tak mungkin. Sudah ada banyak catatan medis yang melaporkannya.
Ketika terjadi suatu hal yang tidak diinginkan, maka studi bisa dihentikan sementara untuk melakukan evaluasi dan investigasi. Dalam hal ini reviewer independen akan dilibatkan.
Mereka akan mulai mencari tahu penyebab kejadian tak diharapkan tersebut. Pertama, mereka akan melihat apakah kejadian tersebut berada di kelompok kontrol atau di kelompok perlakuan.
Apabila di kelompok perlakuan maka, investigasi lanjutan seputar apakah ada keterkaitan antara pemberian calon vaksin/obat dengan penyakit tersebut. Jika memang ada kaitan dan kuat, maka dampaknya terhadap evaluasi klinis bisa sampai dihentikan. Namun jika tidak ada keterkaitan yang serius, studi dapat dilanjutkan.
Dalam kasus kematian seorang relawan uji kandidat vaksinnya, otoritas kesehatan Brazil setelah melakukan review secara independen merekomendasikan agar uji klinis vaksin di negara tersebut dilanjutkan.
Kejadian tak mengenakkan bukan hanya sekali ini saja menimpa AstraZeneca. Sebelumnya pada awal September, uji klinis tahap akhir kandidat vaksin pengembang tersebut juga dihentikan sementara setelah seorang relawan mengatakan terkena gangguan saraf berupa transverse myelitis.
Kala itu seorang relawan asal Inggris dilaporkan mengalami peradangan pada sumsum tulang belakangnya. Namun tak ada signifikansi tingkat keparahan. Uji coba pun kembali dilanjutkan setelah dihentikan secara serempak di Inggris, Brazil dan Afrika Selatan.
Namun masalah transparansi mengapa studi tersebut kembali dilanjutkan banyak mendapat kritikan dari para ilmuwan global.
Mengutip Nature, Paul Komesaroff seorang dokter sekaligus ahli bioetik di Universitas Monash mempertanyakan klaim universitas yang tak bisa mempublikasikan informasi seputar insiden tersebut dengan alasan kerahasiaan.
Menurutnya, informasi penting yang tak menyinggung soal individu terkait seharusnya masih bisa dipublikasikan. Soal transparansi dalam uji klinis vaksin tentu menjadi sorotan banyak pihak.
Marie-Paule Kieny seorang peneliti vaksin dari Paris mengatakan kepada Nature bahwa kepercayaan publik terhadap vaksin akan sangat berpengaruh terhadap dampak yag ditimbulkan terhadap sistem kesehatan. Ia menambahkan kepercayaan ini harus dibangun dengan transparansi.
Selain transparansi informasi, ada masalah lain yang juga disorot oleh tiga ilmuwan AS yang dipublikasikan tujuh tahun silam di BMJ Journal dengan judul Haphazard reporting of deaths in clinical trials: a review of cases of ClinicalTrials.gov records and matched publications-a cross-sectional study.
Early, Lau dan Uhlig menegaskan bahwa standard pelaporan yang komprehensif dalam mencatat kejadian tak diinginkan terutama kematian dalam konteks uji klinis harus dibuat secara komprehensif.
Masalahnya pelaporan insiden kematian dalam studi sangat beragam. Berdasarkan studinya, tiga peneliti itu menemukan bahwa ada setidaknya 123/500 uji klinis yang melaporkan insiden kematian atau persentasenya sekitar 25%.
Insiden kematian dilaporkan beragam di setiap modul uji klinis dan ada juga yang tumpang tindih (overlap). Sebanyak 64% dari catatan melaporkan angka kematian hanya di salah satu modul, 32% di dua modul dan 4% di semuanya.
Kira-kira seperlima (27/123) dari catatan melaporkan jumlah kematian hanya dalam modul untuk evaluasi dampak buruk yang dirasakan peserta uji saat evaluasi berlangsung. Namun tidak ada kematian yang dilaporkan dalam alur peserta sebagai alasan untuk tidak menyelesaikan uji coba.
Kasus Kematian Saat Uji Klinis Berdasarkan Modul 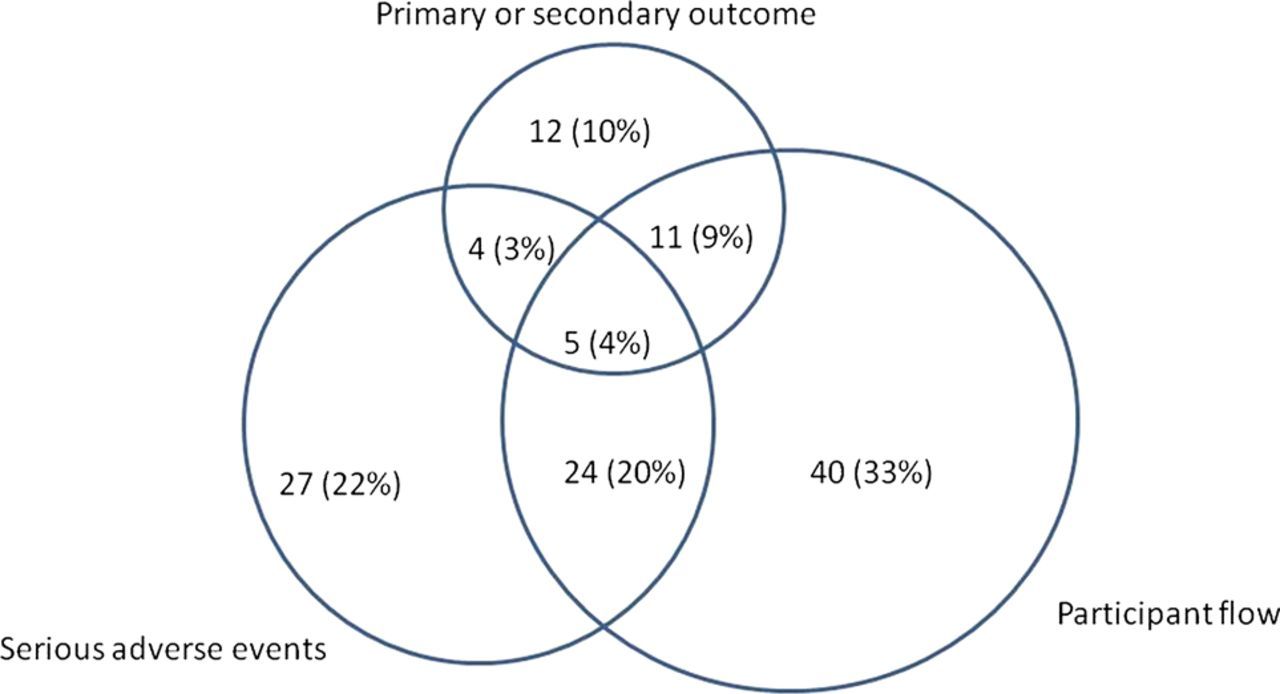 Sumber : Early et al (2013). Haphazard reporting of deaths in clinical trials: a review of cases of ClinicalTrials.gov records and matched publications–a cross-sectional study. BMJ Journal Sumber : Early et al (2013). Haphazard reporting of deaths in clinical trials: a review of cases of ClinicalTrials.gov records and matched publications–a cross-sectional study. BMJ Journal |
Sekali lagi kejadian seperti ini bukan termasuk kejadian luar biasa dalam uji klinis vaksin mengingat jumlahnya yang relatif kecil dibandingkan dengan total sampel uji klinis yang mencapai lebih dari 10 ribu relawan.
Lagipula penyebab kematian bisa jadi bukan karena uji klinis yang dilakukan melainkan karena faktor lain, apalagi jika relawan bukan termasuk kelompok uji. Namun yang terpenting adalah bagaimana transparansi data dan informasi jadi kunci utama untuk membangun kepercayaan publik.
Pada tataran aspek teknis, pelaporan hasil uji klinis juga harus terstandardisasi secara komprehensif dan tidak ambigu sehingga bisa secara objektif dikomunikasikan ke publik.
TIM RISET CNBC INDONESIA
(twg/roy) Add
 as a preferred
as a preferred
source on Google [Gambas:Video CNBC]
Next Article Uji Coba Vaksin Astrazeneca Dihentikan, Pertanda Buruk?